نقش پودر استخوانی در جراحی ایمپلنتهای دندانی
از دست رفتن دندان یکی از شایعترین مشکلاتی است که میتواند به دلایل مختلفی از جمله پوسیدگی شدید، بیماریهای پریودنتال، تروما، بیماری دیابت، افزایش سن و کشیدن سیگار رخ دهد. گفتنی است که از دست رفتن دندان در مردان بیش از زنان شایع است. پیامد این اتفاق نه تنها با از دست رفتن زیبایی و اختلال در عملکرد جویدن و تکلم همراه است بلکه باعث تحلیل تدریجی استخوان فک نیز میشود. ایمپلنتهای دندانی طی دهههای اخیر به عنوان یکی از موفقترینروشهای جایگزینی دندان از دسترفته مطرحشدهاند و به دلیل شباهت عملکردی و زیبایی شناختی با دندان طبیعی، استاندارد طلایی درمان محسوب میشوند. با این حال برای دستیابی به ثبات اولیه و موفقیت طولانی مدت ایمپلنت، وجود حجم و کیفیت کافی از استخوان فک لازم است.
در بسیاری از بیماران به ویژه در نواحی خلفی ماگزیلا یا پس از گذشت مدت طولانی از کشیدن دندان، شرایط ایدهآل استخوانی وجود ندارد. در چنین مواردی استفاده از پودراستخوانی به عنوان یکی از رایجترین و موثرترین روشهای بازسازی، امکان اصلاح نقایص استخوانی و ایجاد بستری مناسب برای کاشت ایمپلنت را فراهم میکند. در واقع این مواد با نقش کلیدی خود در فرآیندهای القای استخوانسازی Osteoconduction و هدایت استخوان سازی Osteoinduction جایگاه مهمی در پروتکلهای بازسازی بافت سخت در دندانپزشکی یافتهاند.
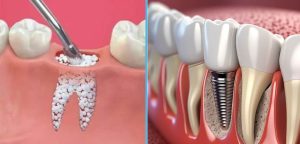
اما چرا استخوان فک تحلیل میرود؟
استخوان آلوئولار فک ساختاری وابسته به حضور دندانها دارد و عملکرد اصلی آن نگهداری ریشه دندان در حفره آلوئولار است. به همین دلیل بعد از کشیدن یا از دست رفتن دندان، تحریک مکانیکی و بیولوژیک ناشی از لیگامان پریودنتال از بین میرود و فرآیند بازسازی فیزیولوژیک استخوان مختل میشود. در نتیجه استخوان فک دچار تحلیل تدریجی میشود.
عوامل متعددی نیز باعث تسریع یا تشدید تحلیل استخوان میشوند که در ادامه به برخی از آنها اشاره میکنیم:
- بیماریهای پریودنتال: این بیماری با تجمع پلاک و باکتریهای پریودنتولوژن باعث التهاب مزمن، آزاد شدن سایتوکاینهای پروالتهابی و فعال شدن استئوکلاستها میشود که بدین ترتیب تحلیل استخوان آغاز شده و حتی پیش از کشیدن دندان، ارتفاع و حجم استخوان کاهش مییابد.
- پروتزهای متحرک: فشار غیرطبیعی و متمرکز پروتزهای متحرک روی استخوان باعث تحریک مکانیکی نامتعادل و نکروز موضعی استخوان میشود. تحلیل استخوان در نواحی تحت فشار پروتز، شدت بیشتری دارد و کاهش ارتفاع استخوان نکتهای قابل توجه است.
- عوامل سیستمیک مانند پوکی استخوان، دیابت، کشیدن سیگار و سن:
- پوکی استخوان: کاهش توده استخوانی اسکلت در بیماران به ویژه در زنان پس از یائسگی منجر به افزایش تحلیل استخوان فک میشود.
- دیابت: کنترل ضعیف قند خون باعث اختلال در تکثیر استئوبلاستها و افزایش فعالیت استئوکلاستها میشود.
- کشیدن سیگار: نیکوتین و محصولات جانبی آن باعث کاهش جریان خون موضعی، اختلال در بازسازی استخوان و کاهش موفقیت ایمپلنتها میشود.
- افزایش سن: کاهش فعالیت متابولیک سلولهای استخوان و افزایش نسبت استخوان اسفنجی به کورتیکال با افزایش سن رخ میدهد. در واقع این فاکتور، تحلیل استخوان را تسریع میکند.
به طور کلی این عوامل نه تنها شرایط کاشت ایمپلنت را دشوار میسازد بلکه به مرور زمان باعث تغییر پروفایل بافت نرم، افت حمایت لب و گونه و مشکلات زیبایی شناختی نیز میشود. بنابراین پیشگیری یا جبران این تحلیلها، یکی از اصلیترین اهداف در دندانپزشکی ایمپلنت و بازسازی بافت سخت است.
اما تحلیل استخوان فک ناگهانی اتفاق نمیافتد و به مرور پیش میرود که سرعت آن در همه بیماران یکسان نیست و اکثر بیماران بعد از پیشرفت مشکل متوجه تحلیل استخوان در فک خود میشوند بنابراین اگر بیماری متقاضی دریافت ایمپلنت است باید قبل از پیشرفت زیاد در تحلیل استخوان فک، تمهیدات لازم را انجام دهد زیرا در نهایت استخوان تا حدی تحلیل میرود که جایگزینی دندان از دست رفته با ایمپلنت دندان حتی به کمک پودر استخوان نیز امکان پذیر نیست.
پودر استخوان در دندانپزشکی
پودر استخوان (Bone Graft Powder)مادهای است که برای بازسازی و افزایش حجم استخوان آلوئولار مورد استفاده قرار میگیرد. این مواد میتوانند از منابع مختلف مانند خود بیمار، انسان دیگر، حیوان یا به صورت سنتتیک تهیه شوند که در ادامه به آنها خواهیم پرداخت. هدف اصلی این پودر ایجاد بستری یرای تشکیل استخوان جدید و فراهم کردن حجم کافی برای کاشت ایمپلنت یا بازسازی نقصهای استخوانی است.
- ویژگیهای کلیدی پودر استخوانی:
Osteoconductive: ایجاد چهارچوبی برای رشد استخوان جدید
Osteoinductive: تحریک تمایز سلولهای بنیادی به استئوبلاستها
Biocompatible: سازگار با بدن بدون ایجاد واکنش ایمنی جدی
انواع پودر استخوانی
پودرهای استخوانی براساس منشا و ویژگیهای بیولوژیک به چهار دسته اصلی تقسیم میشوند:
اتوگرافت (Autograft): استخوان گرفته شده از بدن خود بیمار است و دارای بالاترین پیشبینی موفقیت بدون ریسک رد ایمنی است. اما از معایب آن میتوان به نیاز به برداشت استخوان از ناحیه دیگر بیمار، افزایش زمان و موربیدیتی جراحی اشاره کرد.
آلوگرافت (Allograft): استخوان انسانی گرفته شده از بانک استخوان، که از نظر پزشکی فرآوری و استریل شده است بنابراین نیازی به برداشت استخوان از خود بیمار ندارد و آماده مصرف است اما هزینه بالایی دارد. ریسک انتقل بیماری در این روش کم است.
زنوگرافت (Xenograft): استخوانی که معمولاً از حیواناتی مانند گاو تهیه میشود. پس از پردازشهای خاص، برای بدن انسان ایمن میشود. این محصول دارای ماندگاری و ثبات حجم بالا است در واقع از کلیدی ترین مزایای آن میتوان به حجمدهی خوب و ترمیم بهتر بافت نرم اشاره کرد. از معایب آن میتوان بازسازی محدود استخوان و احتمال واکنش ایمنی جزئی را بازگو کرد.
آلوپلاست (Alloplast): به دنبال عفونت هایی که در برخی پیوندهای آلوگرفت و زنوگرفت گزارش شد مواد مصنوعی مانند هیدروکسیآپاتیت یا فسفاتهای کلسیم به دلیل ویژگیهای شیمیایی، بیولوژیکی و فاز معدنی مشابه ساختار استخوان، به عنوان پودر استخوانی معرفی شدند و میتوانند بدن را به استخوانسازی تحریک کنند. این مواد زیست سازگار، قادر به اتصال به استخوان هستند و رشد استخوان جدید را تحریک میکنند و در عین حال با گذشت زمان جذب میشوند. این محصول قابلیت ترکیب با فاکتور رشد را دارد. اما ایراد آن، پتانسیل کمتر در القای بازسازی کامل استخوان است.
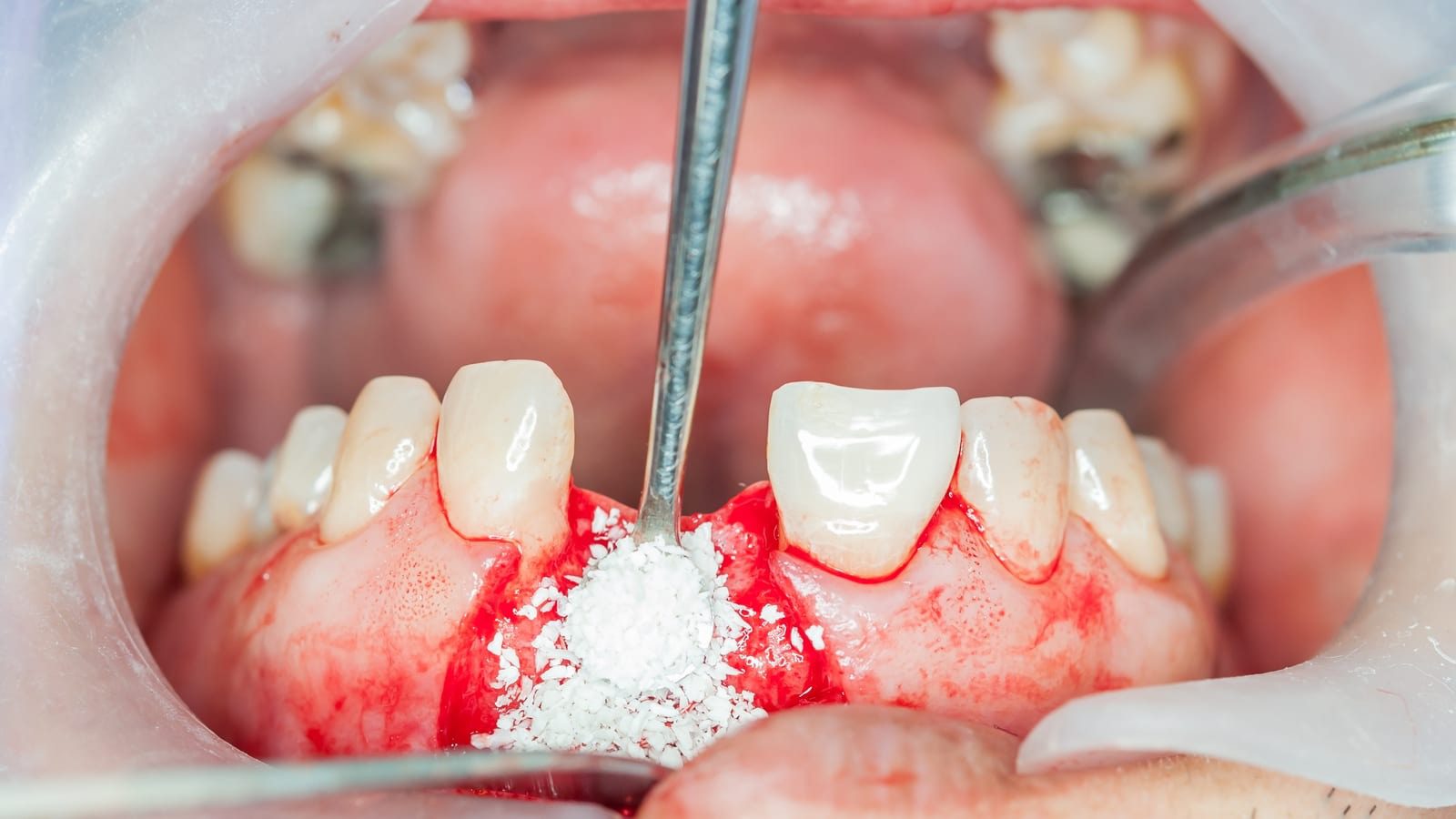
اما گرافت استخوانی چه تفاوتی با پودر استخوان دارد؟
پودر استخوانی معمولا از بافت استخوان خرد شده به دست میآید و به صورت دانههای ریز در نواحی دچار کمبود استخوان قرار میگیرد و به عنوان یک ماده بیولوژیک با تحریک فرآیندهای ترمیمی به بازسازی استخوان کمک میکند. در واقع این ماده برای ترمیم ضایعات کوچک استخوانی مورد استفاده قرار میگیرد. در مقابل گرافت استخوانی به طور کلی به تودههای استخوانی با ساختار سهبعدی اطلاق میشود که میتواند از انواع مختلفی مانند بلوکهای استخوانی، گرافتهای ترکیبی با مواد مصنوعی ساخته شود. این گرافتها علاوه بر داشتن ویژگیهای پودر استخوانی، معمولا دارای ساختارهای بزرگتر و مقاومتری هستند که میتوانند در نواحی با کمبود شدید استخوان یا در فرآیندهای پیچیدهتر مانند لیفت سینوس و بازسازی استخوانهای فک استفاده شوند. در نهایت انتخاب میان پودر استخوانی و گرافت استخوانی بستگی به شرایط بالینی خاص، شدت کمبود استخوان و نیازهای ترمیمی هر بیمار دارد.
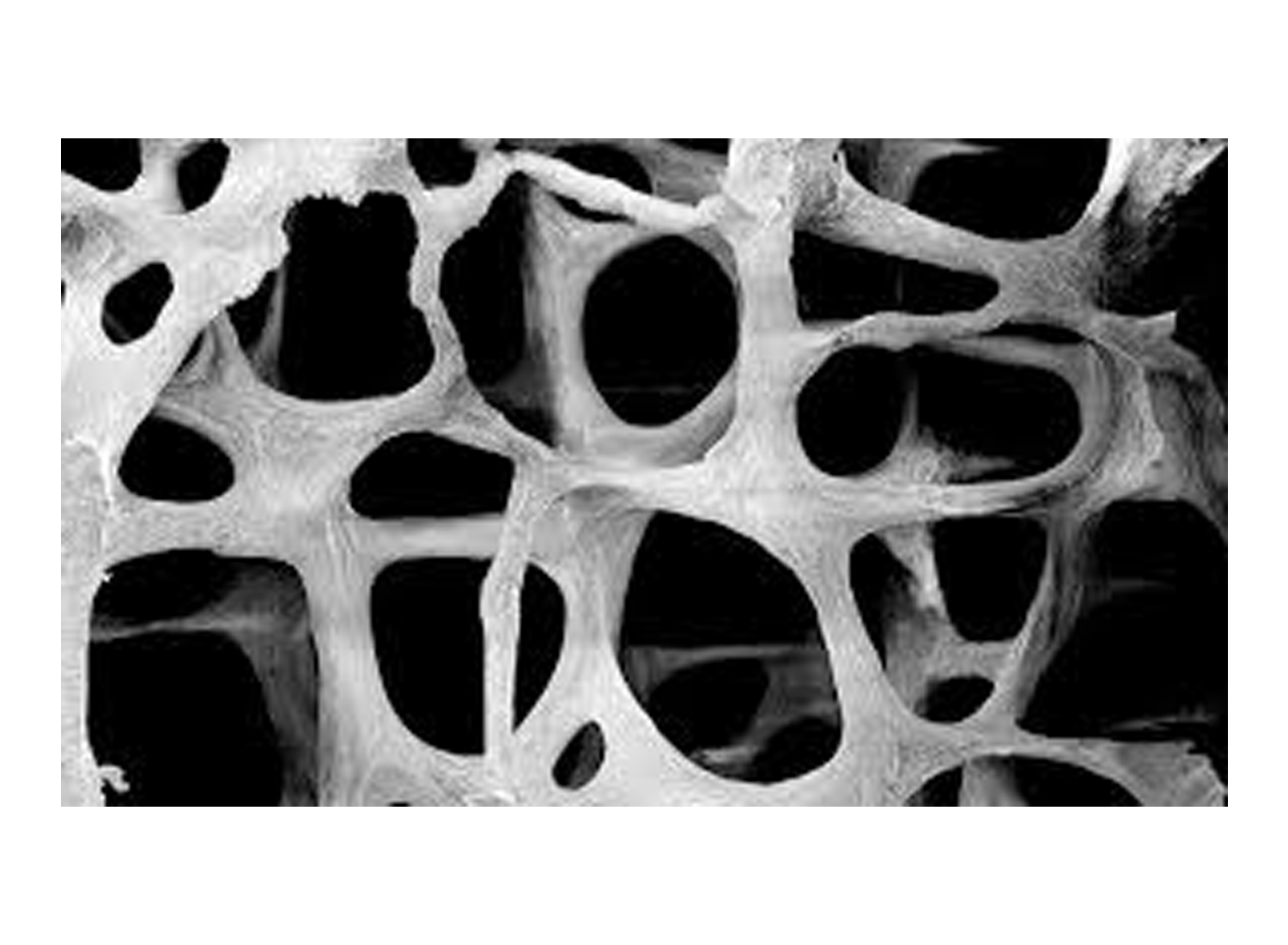
تخلخل پودر استخوانی
گفتنی است که پودر استخوانی باید تخلخل مناسب داشته باشد تا فضای کافی برای رشد سلولهای استخوانی فراهم شده و همچنین نفوذ مایعات در داخل آن برای رشد سلول اتفاق بیافتد.
تخلخل معمولا به دو دسته تقسیم میشود:
میکروپروز(Microporosity): منافذ کوچکی هستند که باعث افزایش سطح تماس، افزایش واکنشهای بیوشیمیایی، جذب مواد و رشد سلولهای استخوانی میشوند.
ماکروپروز(Macroprosity): منافذی بزرگتر از میکروپروزها هستند که برای رشد سلولهای استخوانی و عروق خونی ضروری هستند بنابراین نقش کلیدی در نفوذ سلولها و انتقال مواد مغذی ایفا میکنند.
ترکیب مناسبی از میکروپروز و ماکروپروز باعث میشود که پودر استخوانی هم سطح تماس زیاد برای واکنشهای شیمیایی داشته باشد و هم فضای کافی برای بازسازی و رشد استخوان واقعی ایجاد کند.
پودرهای استخوانی بسته به نوع آن به سه روش عمل میکنند:
استخوان سازی فعال (Osteogenesis): در این حالت خود پودر حاوی سلولهای زنده استخوان ساز مثل سلولهای استئوبلاست است. این سلولها مستقیم استخوان جدید تولید میکنند که معمولا در گرافتهایی مثل اتوگرافت دیده میشود.
القای استخوان سازی (Osteoinductiob): در این حالت پودر حاوی پروتئین و فاکتورهای رشد است که سلولهای بنیادی بدن بیمار را تحریک میکند تا به سلول استخوان ساز تبدیل شوند. بعضی آلوگرفتها یا زنوگرفتها از این دسته هستند.
هدایت استخواان سازی (Osteoconduction): در این حالت پودر نقش داربست (Scaffold) را ایفا میکند یعنی استخوان نمیسازد ولی ساختار سه بعدی ایجاد میکند که سلولهای بدن بتوانند روی آن رشد کنند ودرون حفرات آن استخوان بسازند. این ویژگی در بسیاری از گرافتها به ویژه زنوگرافتها و مواد سینتتیک دیده میشود.
در مجموع میتوان گفت پودر استخوانی به عنوان یکی از پرکاربردترین مواد جایگزین در حوزه دندانپزشکی و جراحیهای فک و صورت، نقشی کلیدی در بازسازی و ترمیم بافتهای استخوانی ایفا میکند. این ماده نه تنها به عنوان یک داربست زیستی عمل کرده و محیط مناسبی را برای رشد و تکثیر سلولهای استخوان ساز فراهم میآورد بلکه در بسیاری از موارد طی فرآیند بازسازی تدریجی با استخوان طبیعی بدن جایگزین میشود. بدین ترتیب پس از گذشت چند ماه، ناحیه درمان شده دارای تراکم و استحکام کافی خواهد بود و شرایط ایدهآل برای قراردادن ایمپلنتهای دندانی ایجاد میگردد. استفاده از پودر استخوانی علاوه بر افزایش موفقیت درمانهای ایمپلنتولوژی، به بهبود زیبایی، عملکرد و پایداری طولانی مدت پروتزهای دندانی کمک شایانی میکند. بنابراین میتوان نتیجه گرفت که به کارگیری این ماده دردندانپزشکی مدرن، رویکردی علمی و کارآمد برای ارتقای کیفیت درمانهای بازسازی و جایگزینی دندان به شمار میرود.
References
.Davda, S., Shado, R., Novo Pereira, I., Madruga, D., & Hassan, H. (2025). Vertical and horizontal bone loss following alveolar socket preservation using bone grafts and autologous platelet concentrates vs bone grafts alone: a systematic review and meta-analysis. BDJ open, 11(1), 11
.Ozzo, S., & Kheirallah, M. (2024). The efficiency of two different synthetic bone graft materials on alveolar ridge preservation after tooth extraction: a split-mouth study. BMC Oral Health, 24(1), 1040
.Khaddour, A. S., Ghiță, R. E., Ionescu, M., Rîcă, R. G., Mercuț, V., Manolea, H. O., ... & Popescu, S. M. (2024). Healing of extraction sites after alveolar ridge preservation using advanced platelet-rich fibrin: A retrospective study. Bioengineering, 11(6), 566
.Kloss, F. R., Kau, T., Heimes, D., Kämmerer, P. W., & Kloss-Brandstätter, A. (2024). Enhanced alveolar ridge preservation with hyaluronic acid-enriched allografts: a comparative study of granular allografts with and without hyaluronic acid addition. International Journal of Implant Dentistry, 10(1), 42
.Marian, D., Toro, G., D’Amico, G., Trotta, M. C., D’Amico, M., Petre, A., ... & Fratila, A. (2024). Challenges and innovations in alveolar bone regeneration: A narrative review on materials, techniques, clinical outcomes, and future directions. Medicina, 61(1), 20
.Sheikh, Z., Hamdan, N., Ikeda, Y., Grynpas, M., Ganss, B., & Glogauer, M. (2017). Natural graft tissues and synthetic biomaterials for periodontal and alveolar bone reconstructive applications: a review. Biomaterials research, 21(1), 9